ST-Zellen
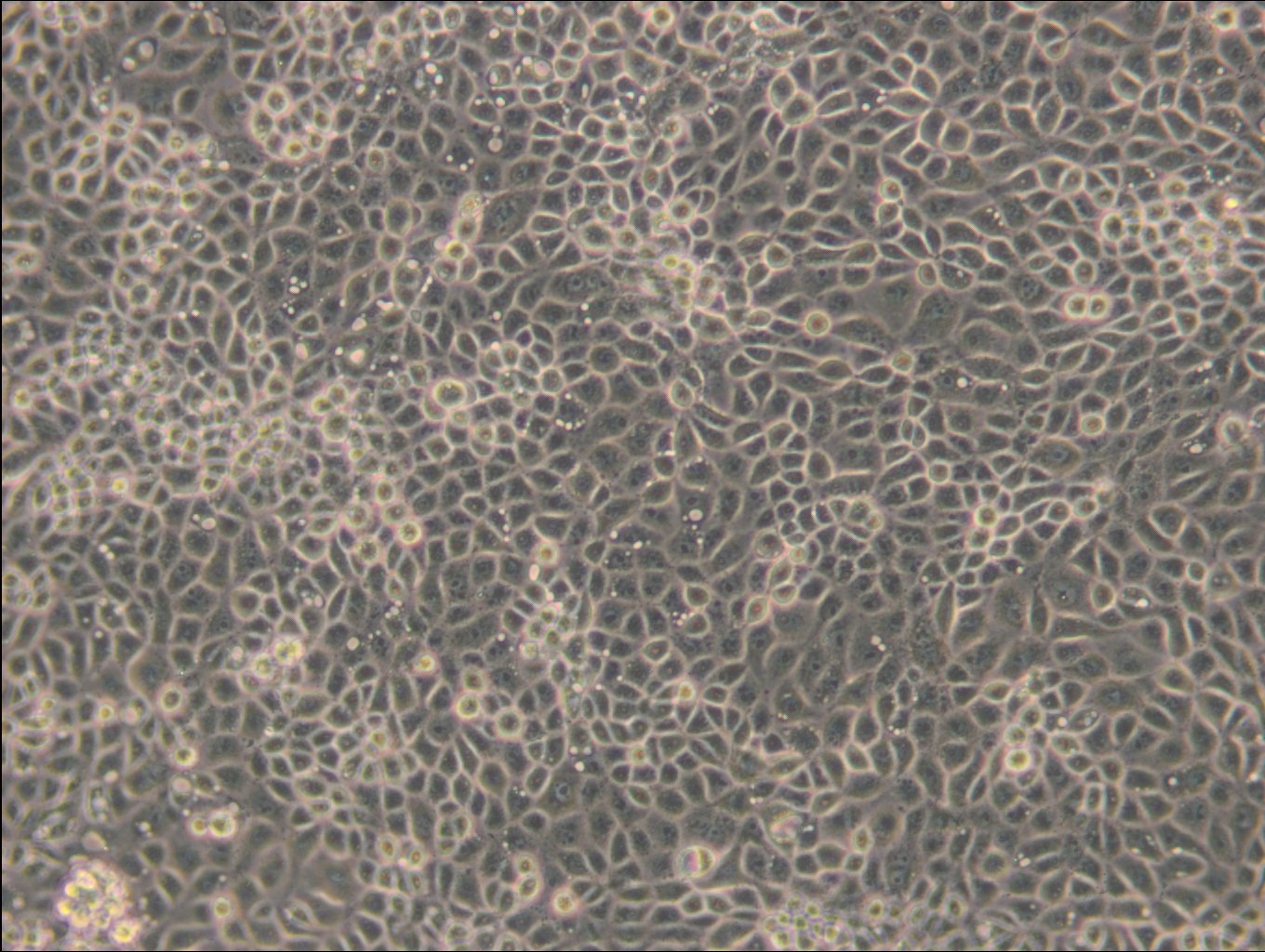
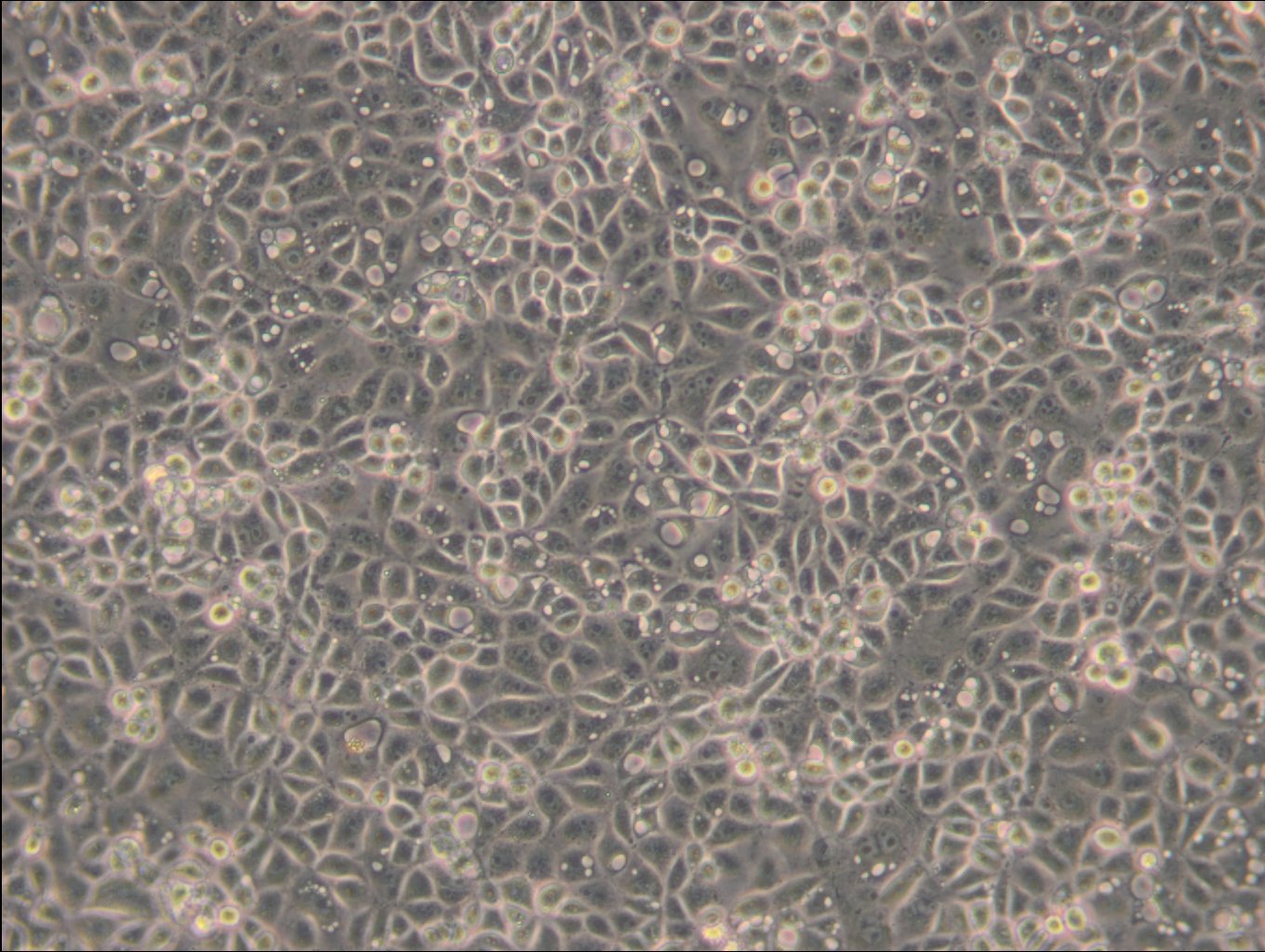
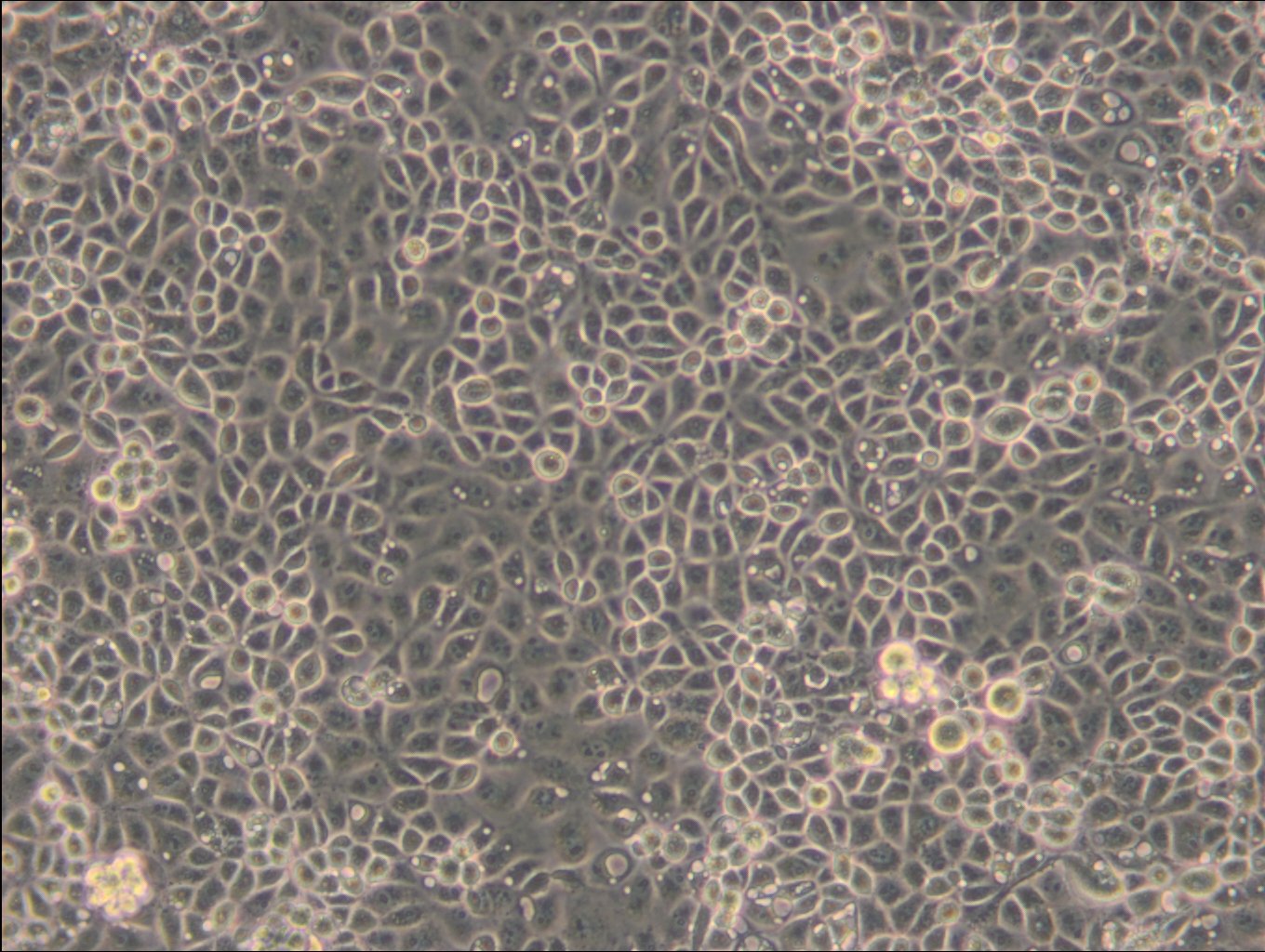
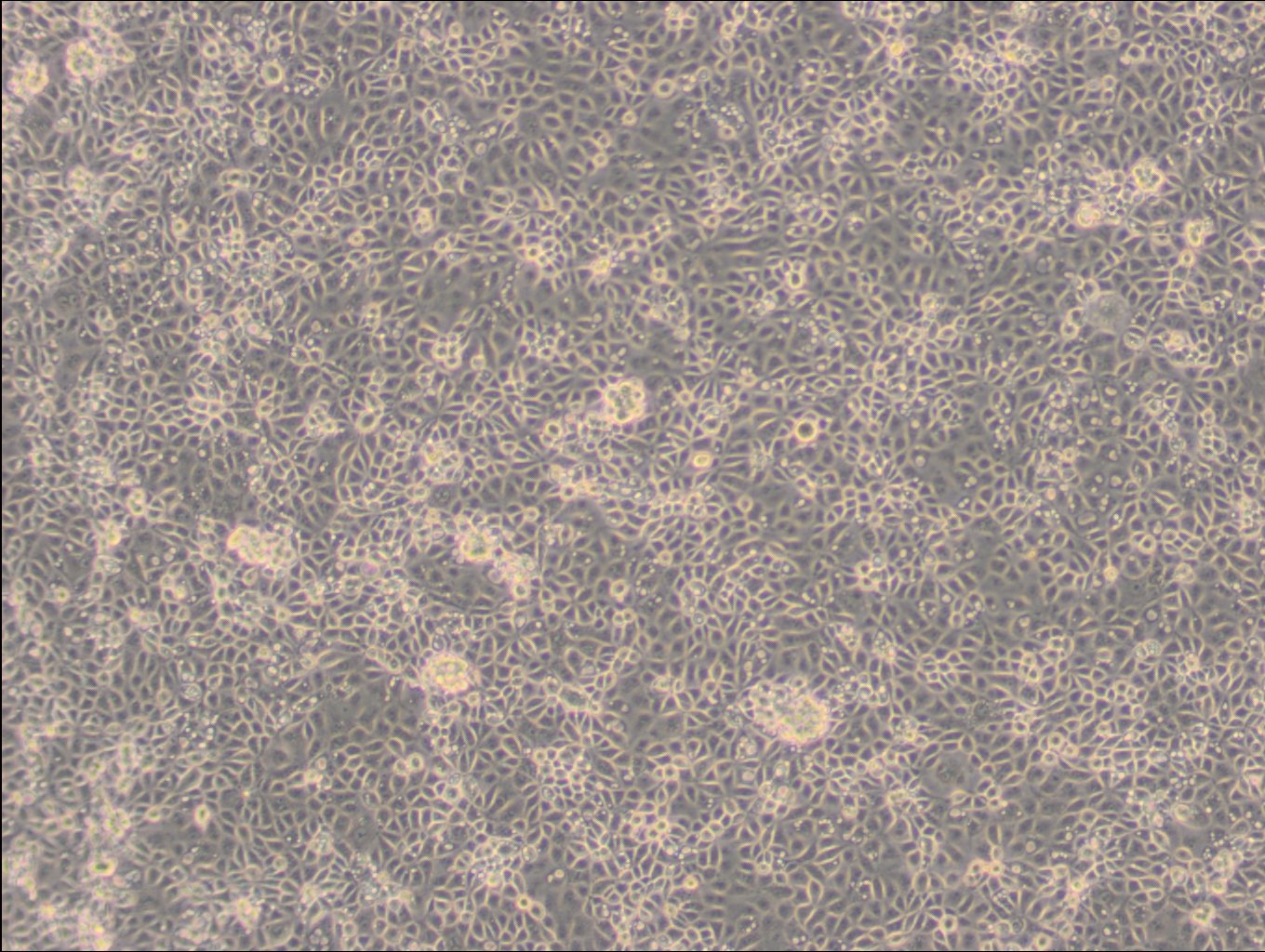
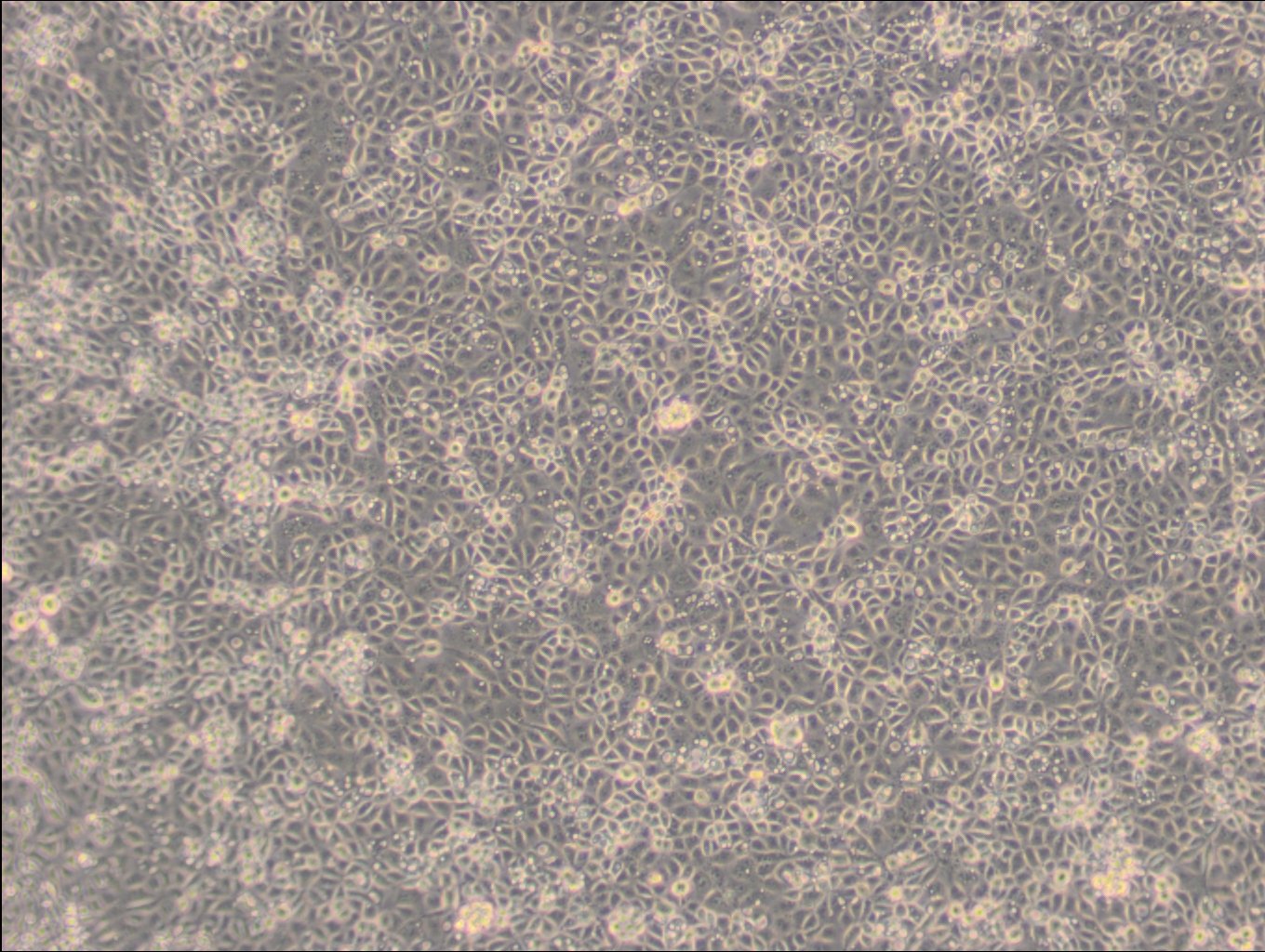
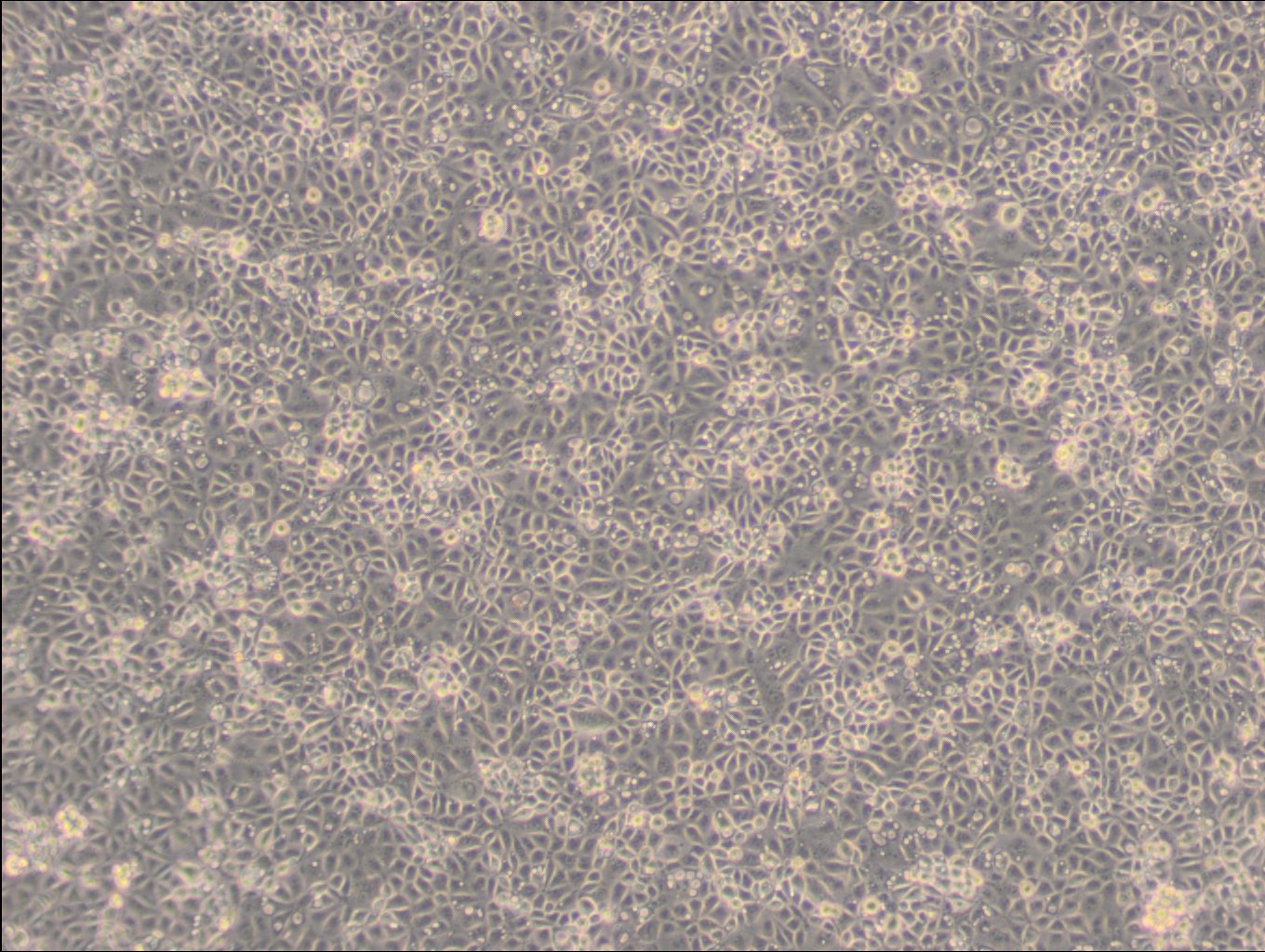


















Allgemeine Informationen
| Organismus | Schwein |
|---|---|
| Gewebe | Hoden |
| Synonyme | Schweinehoden, STOMA24, Stoma 24, ST-IOWA |
Merkmale
| Alter | 80 bis 90 Tage Trächtigkeit |
|---|---|
| Geschlecht | Männlich |
| Morphologie | Fibroblasten |
| Wachstumseigenschaften | Adhärent |
Identifikatoren / Biologische Schutzstufe / Zitation
| Zitat | ST (Cytion Katalognummer 305214) |
|---|---|
| Biosicherheitsstufe | 1 |
Expression / Mutation
Handhabung
| Nährboden | EMEM, w: 2 mM L-Glutamin, w: 1,5 g/L NaHCO3, w: EBSS, w: 1 mM Natriumpyruvat, w: NEAA (Cytion-Artikelnummer 820100c) |
|---|---|
| Mittlere Supplemente | Supplemente des Mediums mit 10% FBS |
| Passage-Lösung | Accutase |
| Subkultivierung | Entfernen Sie das alte Medium von den adhärenten Zellen und waschen Sie sie mit PBS, das kein Kalzium und Magnesium enthält. Für T25-Kolben 3-5 ml PBS und für T75-Kolben 5-10 ml verwenden. Anschließend werden die Zellen vollständig mit Accutase bedeckt, wobei 1-2 ml für T25-Kolben und 2,5 ml für T75-Kolben verwendet werden. Lassen Sie die Zellen 8-10 Minuten bei Raumtemperatur inkubieren, um sie abzulösen. Nach der Inkubation mischen Sie die Zellen vorsichtig mit 10 ml Medium, um sie zu resuspendieren, und zentrifugieren sie dann 3 Minuten lang bei 300xg. Den Überstand verwerfen, die Zellen in frischem Medium resuspendieren und in neue Kolben überführen, die bereits frisches Medium enthalten. |
| Splitverhältnis | 1:2 bis 1:4 |
| Medienwechsel | 2 bis 3 Mal pro Woche |
| Einfriermedium | CM-1 (Cytion Katalognummer 800100) oder CM-ACF (Cytion Katalognummer 806100) |
| Handhabung von kryokonservierten Kulturen |
|
Qualitätskontrolle / Genetisches Profil / HLA
| Sterilität | Eine Kontamination mit Mykoplasmen wird sowohl durch PCR-basierte Assays als auch durch lumineszenzbasierte Mykoplasmen-Nachweisverfahren ausgeschlossen. Um sicherzustellen, dass keine Kontamination mit Bakterien, Pilzen oder Hefen vorliegt, werden die Zellkulturen täglich visuell überprüft. |
|---|
