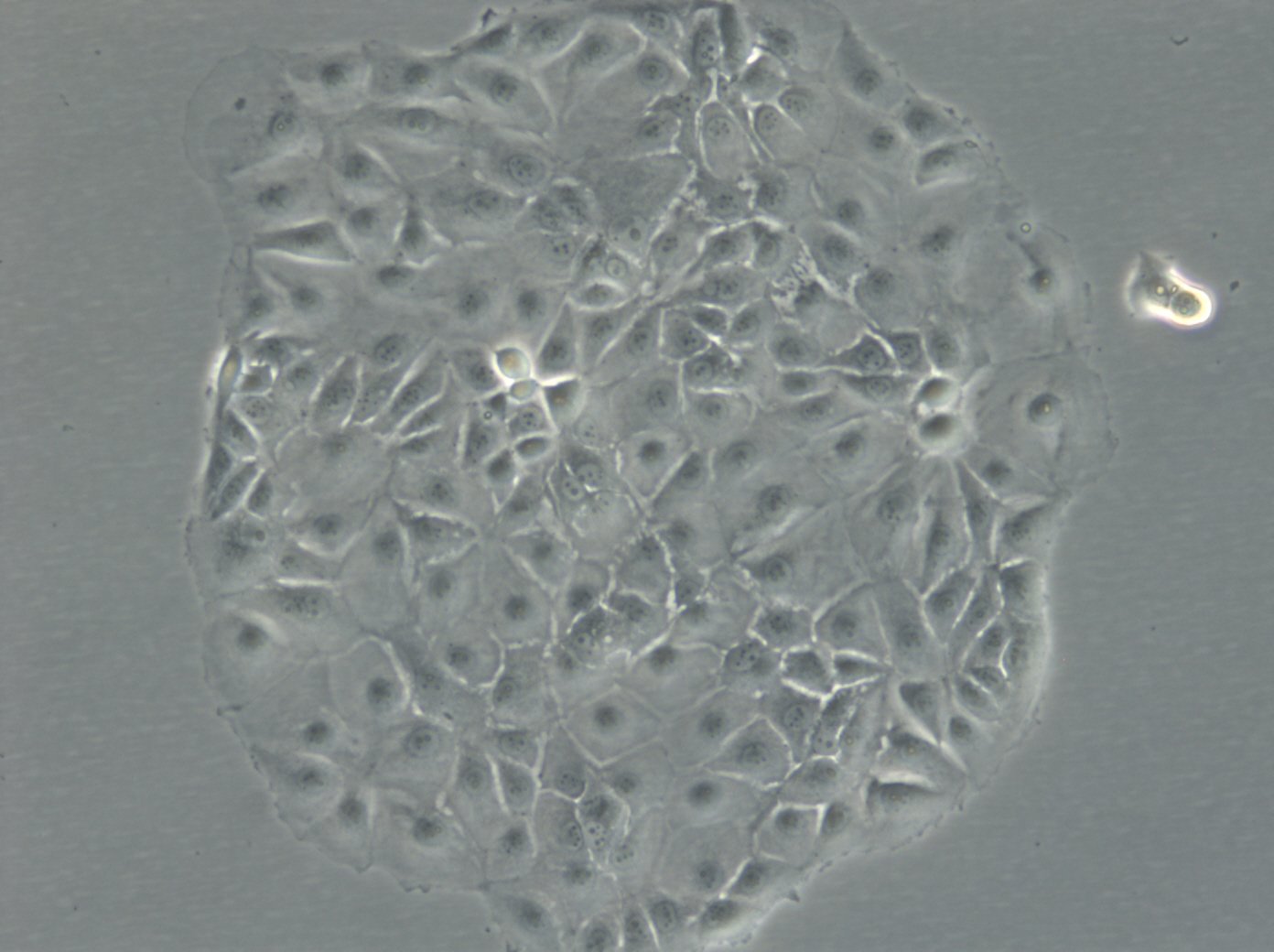
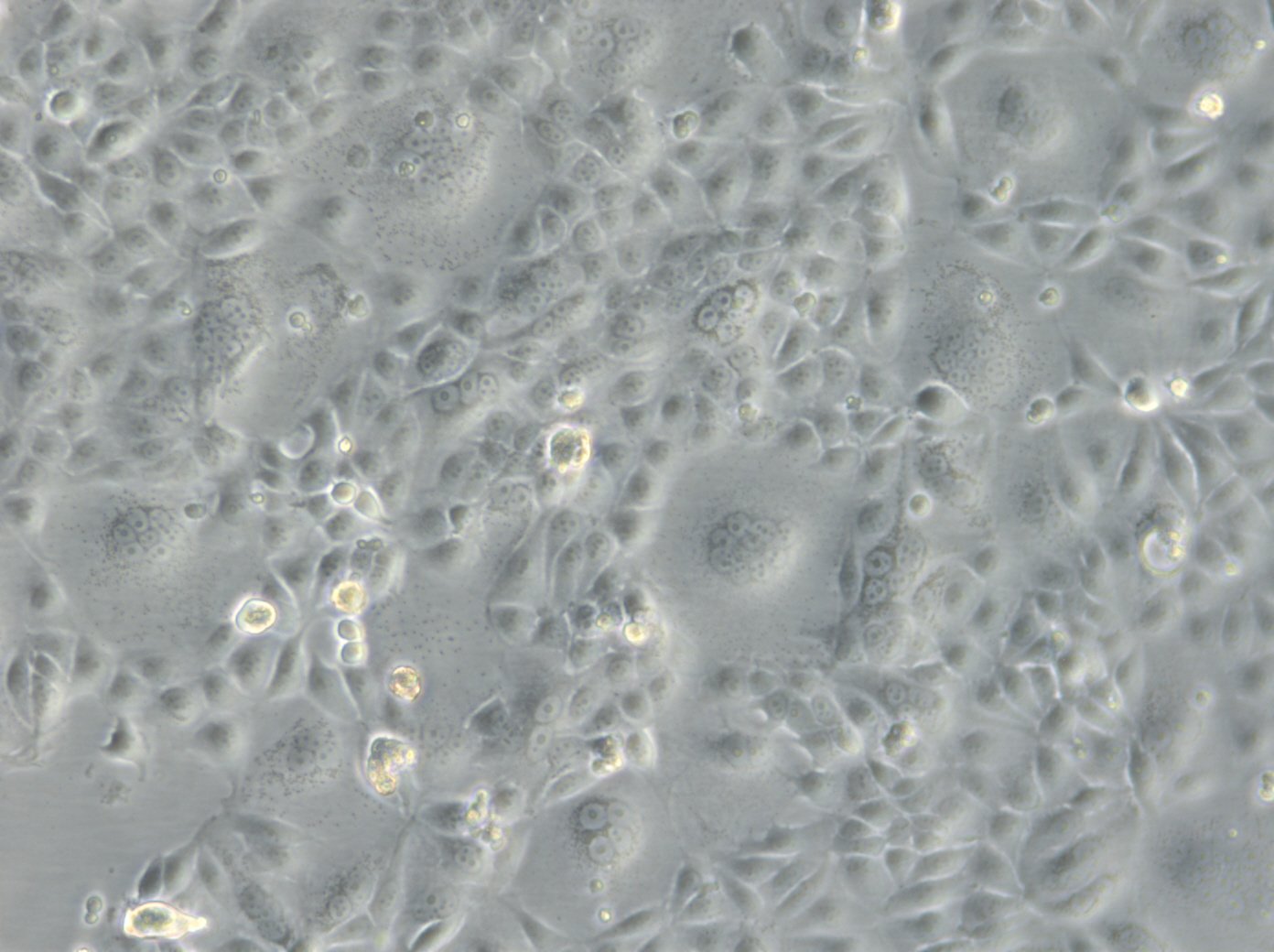
MCF-7-Zellen
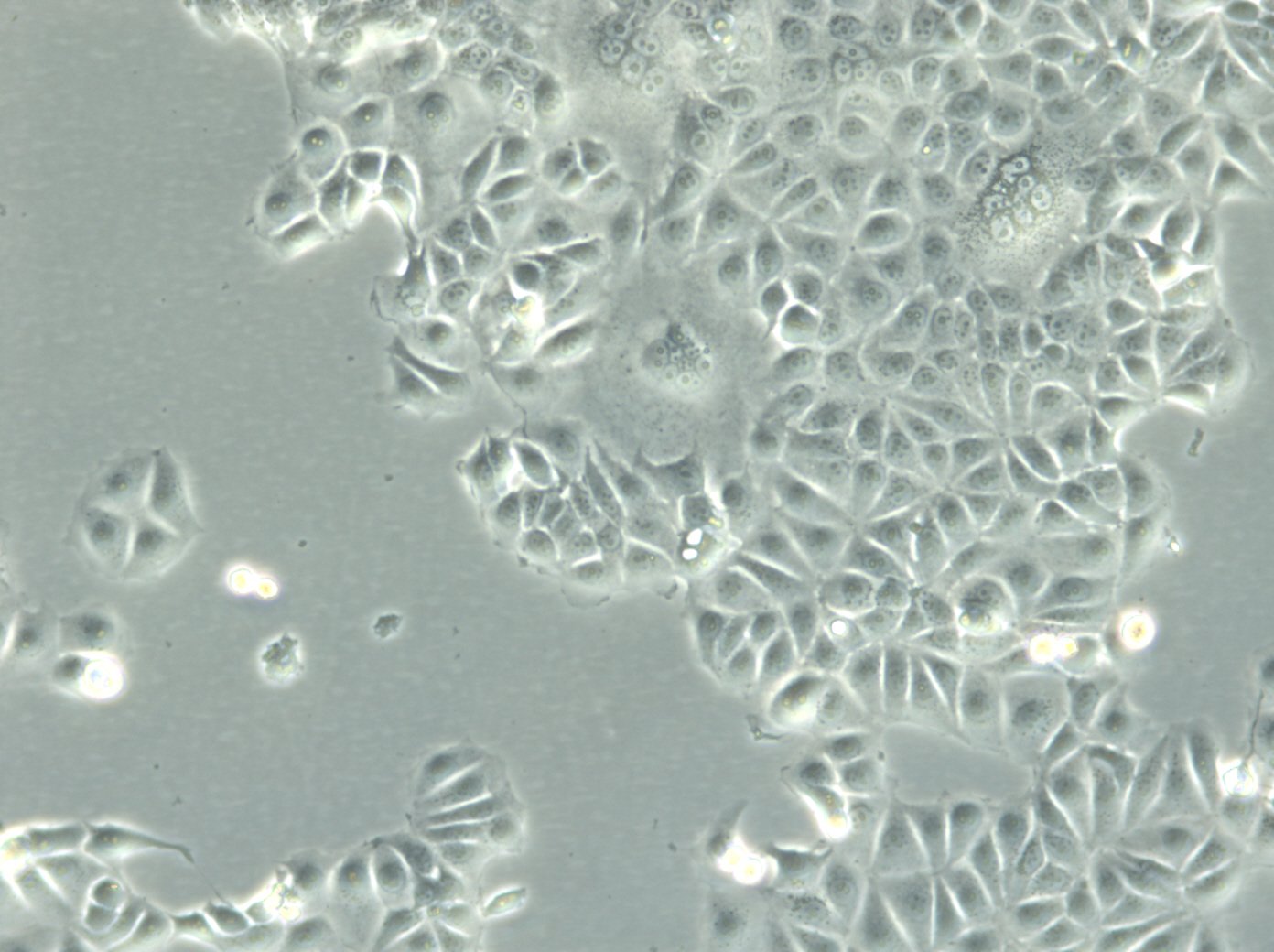









Wesentliche Fakten über die Brustkrebs-Zelllinie MCF7
| Beschreibung | MCF7-Zellen, ein weit verbreitetes Forschungsmodell in der Erforschung von menschlichem Brustkrebs, werden in großem Umfang als In-vitro-Modell für hormonabhängigen Brustkrebs verwendet. MCF7-Zellen, die aus dem Brustgewebe einer 69-jährigen weißen Frau mit metastasierendem Adenokarzinom stammen, sind ein weit verbreitetes In-vitro-Modell für hormonabhängigen Brustkrebs und spiegeln den Subtyp Luminal A wider. Dieser Subtyp zeichnet sich durch einen niedrigeren Grad und eine bessere Prognose im Vergleich zu aggressiveren Formen von Brustkrebs aus. In der Brustkrebsforschung sind MCF-7-Zellen von entscheidender Bedeutung für die Bewertung der Wirksamkeit von Brustkrebsmedikamenten und das Verständnis der Dynamik von Brustkrebsstammzellen. Sie sind von zentraler Bedeutung für die Krebsforschung und dienen als Vergleichsmodell zu aggressiveren Zelllinien wie MDA-MB-231. Die Untersuchung therapeutischer Wirkstoffe wie Tamoxifen und Doxorubicin ist von entscheidender Bedeutung für die Erforschung von Medikamenten gegen hormonabhängigen Brustkrebs und für die Gewinnung von Erkenntnissen über die Wirkungs- und Resistenzmechanismen. Auch die Rolle von Östradiol bei der Modulation des Wachstums und der Eigenschaften dieser Zellen ist angesichts seiner Bedeutung für hormonabhängige Brustkrebsarten von großem Interesse. Die Forschung an der Brustkrebszelllinie MCF7 befasst sich häufig mit den zellulären Prozessen der Zytotoxizität und Apoptose, insbesondere als Reaktion auf Krebsmittel wie Curcumin, das für sein Potenzial zur Krebsprävention bekannt ist. Die Untersuchung von Immunreaktionen, einschließlich der Wirkung des Tumor-Nekrose-Faktors alpha (TNF alpha) und der Auswirkungen bakterieller Antigene, bereichert unser Verständnis der Mikroumgebung des Tumors und potenzieller therapeutischer Ziele zusätzlich. MCF7-Zellen werden sowohl in 2D-Zellkulturen als auch in 3D-Zellkultursystemen, einschließlich Sphäroid-Kulturen, sorgfältig untersucht, um die Mikroumgebung von Tumoren besser zu imitieren. Diese Methoden ermöglichen eine gründlichere Untersuchung des Sphäroidwachstums von Zellen und des Verhaltens von Krebsstammzellen innerhalb von Mikrogeweben in gerüstbasierten Systemen. Die MCF7-Zelllinie mit ihren epithelialen Zelleigenschaften und ihrer Ähnlichkeit mit menschlichen Adenokarzinomzellen ist ein Eckpfeiler der Krebsforschung. Sie erleichtert nicht nur die Erforschung von Brustkrebsmedikamenten und deren Mechanismen, sondern auch die weitergehenden Auswirkungen auf die Krebsbehandlung, einschließlich der potenziellen Rolle von mesenchymalen Stammzellen und der Wirksamkeit gezielter Therapien in vivo-Studien. |
|---|---|
| Organismus | Menschen |
| Gewebe | Brust |
| Krankheit | Adenokarzinom |
| Metastasierender Ort | Pleuraerguss |
| Synonyme | MCF 7, MCF.7, MCF7, Michigan Cancer Foundation-7, ssMCF-7, ssMCF7, MCF7/WT, MCF7-CTRL, IBMF-7 |
Eigenschaften
| Alter | 69 Jahre |
|---|---|
| Geschlecht | Weiblich |
| Ethnizität | Kaukasisch |
| Morphologie | Epithelähnlich |
| Wachstumseigenschaften | Monolayer, anhaftend |
Dokumentation
| Zitat | MCF-7 (Cytion Katalognummer 300273) |
|---|---|
| Biosicherheitsstufe | 1 |
Genetisches Profil
| Exprimierte Rezeptoren | Die Zellen exprimieren den Wildtyp und die Variante des Östrogenrezeptors sowie den Progesteronrezeptor. |
|---|---|
| Proteinexpression | p53 negativ, pGP9.5 negativ, CEA positiv |
| Isoenzyme | PGM3, 1, PGM1, 1-2, ES-D, 1-2, AK-1, 1, GLO-1, 1-2, G6PD, B, |
| Onkogene | wnt7h +, Tx-4 |
| Tumorigene | Ja, in Nacktmäusen |
| Produkte | Insulinähnliche Wachstumsfaktor-Bindungsproteine (IGFBP) BP-2, BP-4, BP-5 |
| Mutationsprofil | TP53 wt |
| Karyotyp | Die Stammlinien-Chromosomenzahl reichte von Hypertriploidie bis Hypotetraploidie, wobei die 2S-Komponente bei 1 % auftrat. Es gab 29 bis 34 Markerchromosomen pro S-Metaphase, 24 bis 28 Marker traten in mindestens 30 % der Zellen auf, und im Allgemeinen waren in über 80 % der Metaphasen ein großer submetazentrischer (M1) und drei große subtelozentrische (M2, M3 und M4) Marker zu erkennen. Es wurden keine DM entdeckt. Chromosom 20 war nullisomisch und x war disomisch. Phänotyp-Häufigkeitsprodukt: 0.0154 |
Methoden zur Kultivierung von MCF7-Zellen
| Nährboden | EMEM, w: 2 mM L-Glutamin, w: 1,5 g/L NaHCO3, w: EBSS, w: 1 mM Natriumpyruvat, w: NEAA (Cytion-Artikelnummer 820100c) |
|---|---|
| Mittlere Supplemente | Supplemente des Mediums mit 10% FBS |
| Passage-Lösung | Accutase |
| Verdopplungszeit | 24 Stunden |
| Subkultivierung | Entfernen Sie das alte Medium von den adhärenten Zellen und waschen Sie sie mit PBS, das kein Kalzium und Magnesium enthält. Für T25-Kolben 3-5 ml PBS und für T75-Kolben 5-10 ml verwenden. Anschließend werden die Zellen vollständig mit Accutase bedeckt, wobei 1-2 ml für T25-Kolben und 2,5 ml für T75-Kolben verwendet werden. Lassen Sie die Zellen 8-10 Minuten bei Raumtemperatur inkubieren, um sie abzulösen. Nach der Inkubation mischen Sie die Zellen vorsichtig mit 10 ml Medium, um sie zu resuspendieren, und zentrifugieren sie dann 3 Minuten lang bei 300xg. Den Überstand verwerfen, die Zellen in frischem Medium resuspendieren und in neue Kolben überführen, die bereits frisches Medium enthalten. |
| Splitverhältnis | Empfohlen wird ein Verhältnis von 1:3 bis 1:6 |
| Aussaatdichte | 3 x 10^4 Zellen/cm^2 |
| Medienwechsel | 2 bis 3 Mal pro Woche |
| Wiederherstellung durch Einfrieren | Lassen Sie die Zellen nach dem Auftauen 48 Stunden lang ruhen |
| Einfriermedium | CM-1 (Cytion Katalognummer 800100) oder CM-ACF (Cytion Katalognummer 806100) |
| Handhabung von kryokonservierten Kulturen |
|
Qualitätskontrolle
| Sterilität | Eine Kontamination mit Mykoplasmen wird sowohl durch PCR-basierte Assays als auch durch lumineszenzbasierte Mykoplasmen-Nachweisverfahren ausgeschlossen. Um sicherzustellen, dass keine Kontamination mit Bakterien, Pilzen oder Hefen vorliegt, werden die Zellkulturen täglich visuell überprüft. |
|---|---|
| STR profile |
CSF1PO: 10
D13S317: 11
D16S539: 11,12
D5S818: 12
D7S820: 8,9
TH01: 6
TPOX: 9,12
vWA: 14,15
D3S1358: 16
D21S11: 30
D18S51: 14
Penta E: 7,12
Penta D: 12
D8S1179: 10,14
FGA: 23,25
D1S1656: 15.3
D6S1043: 12,18
D2S1338: 21,23
D12S391: 18,20
D19S433: 13,14
|
| HLA-Allele |
A*: 02:01:01
B*: 18:01:01, 44:02:01
C*: 05:xx
DRB1*: 03:01:01, 15:01:01
DQA1*: 01:02:01, 05:01:01
DQB1*: 02:01:01, 06:02:01
DPB1*: 02:01:02, 04:01:01
E: 01:01:01
|
Erforderliche Produkte
In der biologischen Forschung ist die Kryokonservierung von Säugetierzellen ein unschätzbares Instrument. Die erfolgreiche Konservierung von Zellen hat oberste Priorität, da der Verlust einer Zelllinie durch Kontamination oder unsachgemäße Lagerungsbedingungen zu Zeit
- und Geldverlusten führt und letztlich die Forschungsergebnisse verzögert. Sobald die Zellen von einem Zellwachstumsmedium in ein Gefriermedium überführt worden sind, werden sie in der Regel mit einer geregelten Geschwindigkeit eingefroren und in flüssigem Stickstoffdampf oder bei unter -130°C in einem mechanischen Tiefkühlschrank gelagert. Das Einfriermedium CM-ACF ermöglicht die Kryokonservierung von Zellen bei unter -130°C (oder in flüssigem Stickstoff), wodurch ein zusätzlicher, kostspieliger Ultratiefkühlschrank überflüssig wird und zeitaufwändige und anspruchsvolle Einfrierprozesse mit kontrollierter Rate entfallen. Die Zellen werden einfach entnommen, das Wachstumsmedium abgesaugt, in CM-ACF resuspendiert, in ein Kryovial überführt und bei einer Temperatur von unter -130 °C gelagert.
Lange Haltbarkeitsdauer
CM-ACF ist ein serumfreies, gebrauchsfertiges Kryokonservierungsmedium, das bis zu einem Jahr im Kühlschrank gelagert werden kann.
Hunderte von Forschern vertrauen darauf
Unser fortschrittliches, serumfreies Zelleinfriermedium CM-ACF ist ein marktführendes Produkt in Deutschland und Europa und zeichnet sich durch zahlreiche Publikationen mit Hunderten von verschiedenen Zelllinien weltweit aus. Wir haben es mit mehr als 1000 Zelllinien aus unserer firmeneigenen Zellbank getestet.
Optimierte serumfreie Inhaltsstoffe
CM-ACF enthält keine Serumprodukte. Serumhaltige Kryokonservierungsmedien haben den Nachteil schwankender Rückgewinnungsraten und unklarer Zusammensetzung. Da die Zusammensetzung und Konzentration von Proteinen und anderen biologischen Komponenten im Serum von Charge zu Charge variiert, kann die Reproduzierbarkeit von Experimenten mit Zellen, die in einem serumhaltigen Medium eingefroren wurden, beeinträchtigt sein. Da jeder Bestandteil von CM-ACF sorgfältig definiert ist, können Sie sich darauf verlassen, dass sich die Zellen immer auf die gleiche Weise erholen.
Enthält DMSO, Glukose, Salze
Pufferkapazität pH = 7,2 bis 7,6
Universell
- auch für die Stammzellkonservierung
Alle gängigen Zelllinien können eingefroren und aufgetaut werden, um viele lebensfähige Zellen zu erhalten. Im Vergleich zu Standardmedien ist die Rückgewinnungsrate selbst bei den empfindlichsten Zellen deutlich höher. Mit CM-ACF lagern wir über 1000 verschiedene Zelllinien mit hervorragendem Erfolg.
Anwendungen & Validierung
Die in unserem CM-ACF Einfriermedium konservierten Zellen können für die Zellzählung, Lebensfähigkeit und Kryokonservierung, Zellkultur, Säugetierzellkultur, Genexpressionsanalyse und Genotypisierung, In-vitro-Transkription und Polymerase-Kettenreaktionen verwendet werden. Die Wirksamkeit jeder Charge wird anhand von CHO-K1-Zellen bewertet. Jede Charge wird auf pH-Wert, Osmolalität, Sterilität und Endotoxine getestet, um eine hohe Qualität zu gewährleisten.
In der biologischen Forschung ist die Kryokonservierung von Säugetierzellen ein unschätzbares Instrument. Die erfolgreiche Konservierung von Zellen hat oberste Priorität, da der Verlust einer Zelllinie durch Kontamination oder unsachgemäße Lagerungsbedingungen zu Zeit
- und Geldverlusten führt und letztlich die Forschungsergebnisse verzögert. Sobald die Zellen von einem Zellwachstumsmedium in ein Einfriermedium überführt wurden, werden sie in der Regel mit einer geregelten Geschwindigkeit eingefroren und in flüssigem Stickstoffdampf oder bei unter -130°C in einem mechanischen Tiefkühlschrank gelagert. Das Einfriermedium CM-1 ermöglicht die Kryokonservierung von Zellen bei unter -130°C (oder in flüssigem Stickstoff), wodurch ein zusätzlicher, kostspieliger Ultratiefkühlschrank überflüssig wird und zeitaufwändige und anspruchsvolle Einfrierprozesse mit kontrollierter Rate entfallen. Die Zellen werden einfach entnommen, das Wachstumsmedium abgesaugt, in CM-1 resuspendiert, in ein Kryovial überführt und bei einer Temperatur von unter -130 °C gelagert.
Lange Haltbarkeitsdauer
CM-1 ist ein serumhaltiges, gebrauchsfertiges Kryokonservierungsmedium, das bis zu einem Jahr im Kühlschrank gelagert werden kann.
Hunderte von Forschern vertrauen darauf
Unser fortschrittliches Zelleinfriermedium CM-1 ist ein marktführendes Produkt in Deutschland und Europa und zeichnet sich durch zahlreiche Publikationen mit Hunderten von verschiedenen Zelllinien weltweit aus. Wir haben es mit mehr als 1000 Zelllinien aus unserer firmeneigenen Zellbank getestet.
Optimierte Inhaltsstoffe
CM-1 enthält Serumprodukte. Serumhaltige Kryokonservierungsmedien schützen die Zellen während des Einfrierens optimal und haben den Vorteil einer hohen Rückgewinnungsrate. Da CM-1 mit einer Vielzahl von Zelllinien getestet wurde, können Sie sich darauf verlassen, dass sich Ihre Zellen immer gut erholen.
Enthält FBS, DMSO, Glukose, Salze
Pufferkapazität pH = 7,2 bis 7,6
Anwendungen & Validierung
Die in unserem Einfriermedium CM-1 konservierten Zellen können für die Zellzählung, Lebensfähigkeit und Kryokonservierung, Zellkultur, Säugetierzellkultur, Genexpressionsanalyse und Genotypisierung, In-vitro-Transkription und Polymerase-Kettenreaktionen verwendet werden. Die Wirksamkeit jeder Charge wird anhand von CHO-K1-Zellen bewertet. Jede Charge wird auf pH-Wert, Osmolalität, Sterilität und Endotoxine getestet, um eine hohe Qualität zu gewährleisten.
Dieses EMEM-Medium besteht aus 2 mM L-Glutamin, 1,5 g/L NaHCO3, EBSS, 1 mM Natriumpyruvat und NEAA.
Was ist in EMEM enthalten?
EMEM ist eine modifizierte Version von Eagle's Minimum Essential Medium und enthält Earle's Balanced Salt Solution, nicht essentielle Aminosäuren, L-Glutamin, Natriumpyruvat und Natriumbicarbonat. Es ist wichtig zu beachten, dass dieser reduzierte Gehalt an Natriumbicarbonat (NaHCO3, 1,5 g/L) für die Verwendung bei 5 % CO2 in der Luft vorgesehen ist. Um seine Wirksamkeit zu erhalten, wird empfohlen, das Medium bei 2 °C bis 8 °C im Dunkeln zu lagern, wenn es nicht verwendet wird.
Wozu wird EMEM verwendet?
Eagle's minimal essential medium (EMEM) ist ein Zellkulturmedium, das Zellen in Gewebekulturen erhalten kann. Das Medium enthält höhere Konzentrationen von Aminosäuren, was eine genauere Annäherung an die Proteinzusammensetzung kultivierter Säugetierzellen ermöglicht. EMEM kann zur Kultivierung verschiedener Zellen verwendet werden, darunter Fibroblasten, menschliche Leberkrebszellen (HepG2) und Astrozytenzellen aus fötalen Gehirnvorläuferzellen (PDA). Es wird in der Regel in Gegenwart von fötalem Rinderserum (FBS), Kalbs
- oder Pferdeserum verwendet.
Wie unterscheidet sich EMEM von anderen Zellkulturmedien?
EMEM und Dulbecco's modified Eagle's medium (DMEM) haben zwar einige Gemeinsamkeiten, unterscheiden sich aber auch. Beide Medien sind proteinarm und enthalten die Aminosäuren, Salze, Glukose und Vitamine, die erforderlich sind, um eine Zelle mit Energie zu versorgen und sie in der Gewebekultur zu erhalten. Die DMEM-Formulierung ist jedoch so modifiziert, dass sie bis zu viermal mehr Vitamine und Aminosäuren und zwei
- bis viermal mehr Glukose enthält als EMEM. Es sei darauf hingewiesen, dass sich EMEM auch von der ursprünglichen MEM-Formulierung unterscheidet.
Qualitätskontrolle
pH = 7,2 +/
- 0,02 bei 20-25°C.
Jede Charge wurde auf Sterilität und Abwesenheit von Mykoplasmen und Bakterien getestet.
Wartung
Gekühlt bei +2°C bis +8°C im Dunkeln aufbewahren. Einfrieren und Erwärmen bis zu +37° C mindern die Qualität des Produkts.
Erwärmen Sie das Medium nicht auf mehr als 37° C und verwenden Sie keine unkontrollierbaren Wärmequellen (z.B. Mikrowellengeräte).
Wenn nur ein Teil des Mediums verwendet werden soll, nehmen Sie diese Menge aus der Flasche und erwärmen Sie sie bei Raumtemperatur.
Die Haltbarkeit eines jeden Mediums mit Ausnahme des Basismediums beträgt 8 Wochen ab dem Herstellungsdatum.
Zusammensetzung
Bestandteile
mg/L
Anorganische Salze
Calciumchlorid x 2H2O
264,92
Magnesium-Sulfat
97,67
Kaliumchlorid
400,00
Natriumchlorid
6,800.00
Natriumdihydrogenphosphat x H2O
140,00
Sonstige Bestandteile
D(+)-Glucose
1,000.00
Phenolrot
10,00
Natriumpyruvat
110,00
NaHCO3
1,500.00
Aminosäuren
L-Alanin
8,90
L-Arginin x HCl
126,00
L-Asparagin x H2O
13,20
L-Asparaginsäure
13,30
L-Cystin
24,00
L-Glutamin
292,30
L-Glutaminsäure
14,70
Glycin
7,50
L-Histidin x HCl x H2O
42,00
L-Isoleucin
52,00
L-Leucin
52,00
L-Lysin x HCl
72,50
L-Methionin
15,00
L-Phenylalanin
32,00
L-Prolin
11,50
L-Serin
10,50
L-Threonin
48,00
L-Tryptophan
10,00
L-Tyrosin
36,00
L-Valin
46,00
Vitamine
D-Calciumpantothenat
1,00
Cholinchlorid
1,00
Folsäure
1,00
myo-Inositol
2,00
Nicotinamid
1,00
Pyridoxal x HCl
1,00
Riboflavin
0,10
Thiamin x HCl
1,00
- eine schonende Alternative zu Trypsin
Accutase ist eine Zellablösungslösung, die die Zellkulturindustrie revolutioniert. Es ist eine Mischung aus proteolytischen und kollagenolytischen Enzymen, die die Wirkung von Trypsin und Kollagenase nachahmt. Im Gegensatz zu Trypsin enthält Accutase keine Säugetier
- oder Bakterienbestandteile und ist sehr viel schonender für die Zellen, was es zu einer idealen Lösung für die routinemäßige Ablösung von Zellen von Standardplastikgefäßen für die Gewebekultur und adhäsionsbeschichteten Plastikgefäßen macht. In diesem Blogbeitrag gehen wir auf die Vorteile und Einsatzmöglichkeiten von Accutase ein und zeigen, wie es die Zellkultur verändert.
Vorteile von Accutase
Accutase hat mehrere Vorteile gegenüber herkömmlichen Trypsinlösungen. Erstens kann es immer dann eingesetzt werden, wenn eine sanfte und effiziente Ablösung von adhärenten Zelllinien erforderlich ist, und ist somit ein direkter Ersatz für Trypsin. Zweitens funktioniert Accutase sehr gut bei embryonalen und neuronalen Stammzellen, und es hat sich gezeigt, dass die Lebensfähigkeit dieser Zellen nach der Passage erhalten bleibt. Drittens bewahrt Accutase die meisten Epitope für die anschließende durchflusszytometrische Analyse, was es ideal für die Analyse von Zelloberflächenmarkern macht.
Außerdem muss Accutase bei der Passage von adhärenten Zellen nicht neutralisiert werden. Durch die Zugabe weiterer Medien nach der Zellteilung wird die Accutase verdünnt, so dass sie nicht mehr in der Lage ist, Zellen abzulösen. Dadurch entfällt der Schritt der Inaktivierung, und die Zellkulturtechniker sparen Zeit. Schließlich muss Accutase nicht aliquotiert werden, und eine Flasche ist im Kühlschrank 2 Monate lang haltbar.
Anwendungen von Accutase
Accutase ist ein direkter Ersatz für Trypsinlösung und kann für die Passage von Zelllinien verwendet werden. Darüber hinaus eignet sich Accutase gut zum Ablösen von Zellen für die Analyse vieler Zelloberflächenmarker mittels Durchflusszytometrie und für die Zellsortierung. Andere nachgeschaltete Anwendungen der Accutase-Behandlung umfassen die Analyse von Zelloberflächenmarkern, Viruswachstumstests, Zellproliferation, Tumorzellmigrationsassays, routinemäßige Zellpassage, Produktionsskalierung (Bioreaktor) und Durchflusszytometrie.
Zusammensetzung von Accutase
Accutase enthält keine Bestandteile von Säugetieren oder Bakterien und ist eine natürliche Enzymmischung mit proteolytischer und kollagenolytischer Enzymaktivität. Es ist in einer viel niedrigeren Konzentration als Trypsin und Kollagenase formuliert, wodurch es weniger toxisch und sanfter, aber genauso wirksam ist.
Wirksamkeit von Accutase
Accutase ist nachweislich effizient bei der Ablösung von Primär
- und Stammzellen und erhält die hohe Lebensfähigkeit der Zellen im Vergleich zu Enzymen tierischen Ursprungs wie Trypsin. 100 % der Zellen werden nach 10 Minuten zurückgewonnen, und dank der Selbstverdauung von Accutase ist es unbedenklich, Zellen bis zu 45 Minuten in Accutase zu belassen.
Zusammenfassung
Zusammenfassend lässt sich sagen, dass Accutase eine leistungsstarke Lösung ist, die das Spiel in der Zellkultur verändert. Mit seiner sanften Natur, Effizienz und Vielseitigkeit ist Accutase die ideale Alternative zu Trypsin. Wenn Sie nach einer zuverlässigen und effizienten Lösung für die Zellablösung suchen, ist Accutase die richtige Lösung für Sie.
Phosphatgepufferte Kochsalzlösung (PBS) ist eine vielseitige Pufferlösung, die in vielen biologischen und chemischen Anwendungen sowie bei der Gewebeverarbeitung eingesetzt wird. Unsere PBS-Lösung ist mit hochwertigen Inhaltsstoffen formuliert, um einen konstanten pH-Wert während der Experimente zu gewährleisten. Die Osmolarität und die Ionenkonzentration unserer PBS-Lösung sind auf die des menschlichen Körpers abgestimmt, so dass sie isotonisch und für die meisten Zellen nicht toxisch ist.
Zusammensetzung unserer PBS-Lösung
Unsere PBS-Lösung ist eine pH-angepasste Mischung aus hochreinen Phosphatpuffern und Kochsalzlösungen. Bei einer 1fachen Arbeitskonzentration enthält sie 137 mM NaCl, 2,7 mM KCl, 8 mM Na2HPO4 und 2 mM KH2PO4. Wir haben diese Zusammensetzung auf der Grundlage von CSHL-Protokollen und der Molekularen Klonierung nach Sambrook gewählt, die in der Forschungsgemeinschaft etablierte Standards sind.
Anwendungen unserer PBS-Lösung
Unsere PBS-Lösung ist ideal für eine Vielzahl von Anwendungen in der biologischen Forschung. Aufgrund ihrer isotonischen und ungiftigen Eigenschaften eignet sie sich perfekt für die Verdünnung von Substanzen und das Spülen von Zellbehältern. Unsere PBS-Lösung mit EDTA kann auch zum Lösen von angehefteten und verklumpten Zellen verwendet werden. Es ist jedoch wichtig zu beachten, dass zweiwertige Metalle wie Zink nicht zu PBS hinzugefügt werden dürfen, da dies zu Ausfällungen führen kann. In solchen Fällen werden Good's Puffer empfohlen. Darüber hinaus hat sich unsere PBS-Lösung als akzeptable Alternative zu viralen Transportmedien für den Transport und die Lagerung von RNA-Viren, wie z. B. SARS-CoV-2, erwiesen.
Lagerung unserer PBS-Lösung
Unsere PBS-Lösung kann bei Raumtemperatur gelagert werden und ist somit leicht zu verwenden und zugänglich.
Zusammenfassend
Zusammenfassend lässt sich sagen, dass unsere PBS-Lösung bei vielen biologischen und chemischen Experimenten ein wesentlicher Bestandteil ist. Aufgrund ihrer isotonischen und ungiftigen Eigenschaften eignet sie sich für zahlreiche Anwendungen, von der Zellkultur bis zum Virustransportmedium. Durch die Wahl unserer hochwertigen PBS-Lösung können Forscher ihre Experimente optimieren und genaue und zuverlässige Ergebnisse erzielen.
Zusammensetzung
Bestandteile
mg/L
Anorganische Salze
Kaliumchlorid
200,00
Kaliumdihydrogenphosphat
200,00
Natriumchlorid
8,000.00
di-Natriumhydrogenphosphat wasserfrei
1,150.00